
Sterilisations-Regeln zwingen Praxen zum Einwegbesteck
Mehr Kontrolle, mehr Kosten, mehr Müll: Ärzte kritisieren seit längerem die Sterilisationsauflagen von Swissmedic. Nun geht ein SP-Parlamentarier in Basel das Problem kantonal an.

Loading

Mehr Kontrolle, mehr Kosten, mehr Müll: Ärzte kritisieren seit längerem die Sterilisationsauflagen von Swissmedic. Nun geht ein SP-Parlamentarier in Basel das Problem kantonal an.

Der Ständerat will nicht, dass Kosten gespart werden, indem der Kauf von Medikamenten im Ausland zulasten der Grundversicherung ermöglicht wird.

Zahlreiche Spitäler erfüllen Anforderungen bei Qualitätsmanagent und Dokumentation nicht. Allerdings: Eine unmittelbare Gefährdung für Patienten wurde nicht festgestellt.

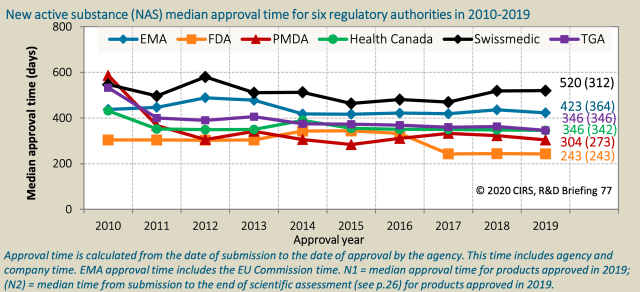
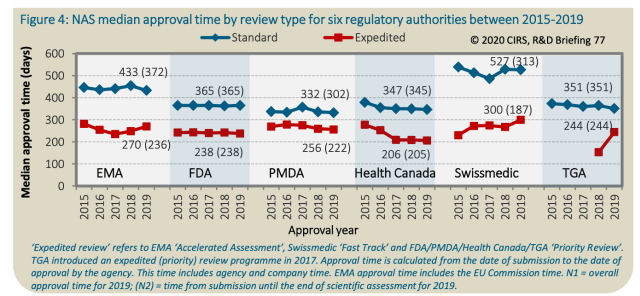
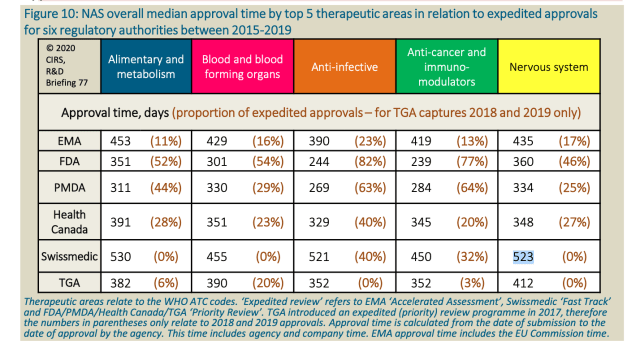
Ein internationaler Vergleich zeigt erhebliche Unterschiede bei den Zulassungszeiten neuer Behandlungen. Während die Pharmaindustrie die langwierigen Verfahren kritisiert, hebt Swissmedic seine Fortschritte hervor.

Donald Trump drängt ultimativ auf tiefere Medikamentenpreise für die USA – auf Kosten kleiner Märkte. Die Pharmabranche fordert nun rasche und entschlossene Reformen in der Schweiz.

Nahrungsergänzungsmittel füllen die Regale – in Apotheken, Supermärkten und Online-Shops. Aber viele Werbeversprechen sind unzulässig. Eine juristische Einordnung, wo die Grenzen verlaufen – und was bei der Vermarktung in der Schweiz zu beachten ist.
Bei einer Patientin traten nach einer Darmspiegelung unerwartet schwere Komplikationen auf. Das Bundesgericht stellt nun klar: Die Ärztin aus dem Kanton Aargau kann sich auf die «hypothetische Einwilligung» der Patientin berufen.
Neue Studie aus den USA wirft Fragen auf: Wettbewerb allein garantiert keine besseren Operationsergebnisse.

Während der Ausbildung nimmt das Einfühlungsvermögen von angehenden Ärztinnen und Ärzten tendenziell ab: Das besagt eine neue Studie.